2021年1月,中国科学院上海营养与健康研究所研究员胡国宏团队在国际著名肿瘤期刊Cancer Cell上在线发表了题为“Cathepsin C Promotes Breast Cancer Lung Metastasis by Modulating Neutrophil Infiltration and Neutrophil Extracellular Trap Formation”的新研究成果,阐明了组织蛋白酶C(CTSC)在乳腺癌肺转移过程中的作用、机理及临床意义。
肺转移是乳腺癌相关死亡的主要原因。研究发现肿瘤分泌的CTSC可作为乳腺癌肺转移风险的一个血清学标记和治疗乳腺癌肺转移的新靶点。机制研究表明,CTSC通过调控转移微环境中中性粒细胞的浸润和中性粒细胞胞外陷阱(NETs)的形成,促进乳腺癌细胞发生肺转移。肿瘤分泌的CTSC通过酶切激活中性粒细胞膜定位PR3促进中性粒细胞中IL-1β的成熟和释放,从而上调中性粒细胞NF-κB信号通路和IL-6、CCL3等细胞因子的分泌,进而增加肺转移微环境中中性粒细胞的累积。同时,肿瘤分泌的CTSC通过PR3-IL-1β-p38/MAPK上调中性粒细胞ROS水平,诱导中性粒细胞产生中NETs进而降解肺转移微环境中抗肿瘤因子TSP-1。对自发肺转移的原位移植模型小鼠使用特异性抑制CTSC的临床二期小分子化合物AZD7986后,显著抑制乳腺癌肺转移的发生。
研究发现,CTSC是乳腺癌肺转移中具有标记作用和功能的分子,说明了微环境对癌细胞转移的重要调控作用,为治疗乳腺癌病人的肺转移提供了新的理论基础。
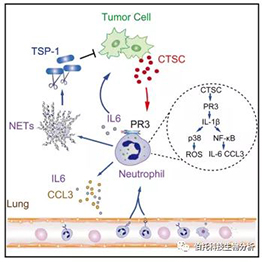
CTSC调控中性粒细胞及乳腺癌肺转移的功能机制示意图
(1) 肿瘤分泌的 CTSC 通过调节中性粒细胞促进胸肺转移。
(2) CTSC 激活中性粒细胞的膜结合 PR3 以上调 IL-IL-1β 分泌。
(3) CTSC 增强中性粒细胞募集到转移性生态位并诱导累积。
(4) AZD7986靶向CTSC可有效抑制小鼠肺转移。
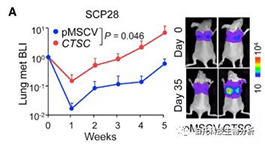
静脉注射具有 CTSC 过表达的 SCP28 用于肺定植分析。显示的是生物发光成像 (BLI) 量化和代表性图像
(A)(n = 9 和 10 只小鼠分别用于对照组和过度表达组)
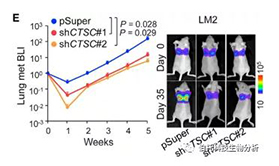
静脉注射具有 CTSC 敲除的 LM2 用于肺转移分析。
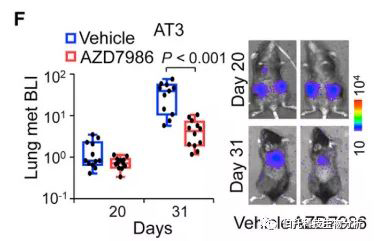
原位注射AT3后AZD7986对小鼠的治疗效果。
*:本文献中使用了德国伯托的小动物活体影像系统Berthold NightOWL LB983。
文章链接:
https://doi.org/10.1016/j.ccell.2020.12.012
